以 KIO3 滴定維生素 C,不加 KI 也能進行?
維生素 C 的定量方式有許多種,本實驗只是其中的方法之一。
(1) 常見維生素 C 定量,是以 I2 與維生素 C 進行快速的氧化還原反應:
Ascorbic acid + I2 → Dehydroascorbic acid + 2I–
但配製標準濃度 I2 溶液時,固態碘在稱量過程中易揮發,且 I2 在水中溶解度較差(故加入KI,使 I2 以 I3– 的形式存在而增加溶解度),因此配製好的 I3– 標準溶液,尚須進一步標定其精確濃度。
I2(aq) + I–(aq) ⇌ I3–(aq)
另一種產生 I3– 標準濃度溶液的方法為:以 KIO3 標準濃度溶液(濃度可較精確配製)與過量 I- 反應產生 I2(I3–),而再與維生素 C 反應。
IO3– + 8I–+ 6H+ → 3I3– + 3H2O
參考:D. C. Harris, Quantitative Chemical Analysis, 5th ed., W. H. Freeman and Co.: New York, 1999, pp.429-436.
(2) 根據標準還原電位,KIO3確實是可與維生素 C 直接反應,我們也操作實驗證實了:不加KI,KIO3 是可直接與維生素 C 反應;也查到有相關實驗設計是不加 KI 直接進行滴定:
| VitC(ox) + 2H+ + 2e– ⇌ VitC(red) + H2O | Eo = 0.390 V |
| IO3– + 6H+ + 6e– ⇌ I– + 3H2O | Eo = 1.085 V |
| 2IO3– + 12H+ + 10e– ⇌ I2 + 6H2O | Eo = 1.19 V |
| I2 + 2e– ⇌ 2I– | Eo = 0.535 V |
| IO3– + 3VitC(red) ⇌ 3VitC(ox) + I– | Eo = 1.085 – 0.390 = 0.695 V |
| 2IO3– + 5VitC(red)+ 2H+⇌ 5VitC(ox) + H2O + I2 | Eo = 1.19 – 0.390 = 0.80 V |
| IO3– + 5I– + 6H+ ⇌ 3I2 + 3H2O | Eo = 1.19 – 0.535 = 0.655 V |
(3) 目前我們尚未查到正式的參考資料,說明為什麼不直接以 KIO3 進行滴定。我們認為 KIO3 的還原電位高,會與它反應的物質較多,於複雜系統(如天然果汁),可能會與其他物質進行氧化還原反應而造成誤差。因此以 KIO3 與 KI 反應先產生 I2 分子,再由 I2 分子與維生素 C 進行反應。
為什麼 KI 的量要隨著維生素 C 的量增加而增加?
參考前題,KIO3可與 KI 反應也可直接與維生素 C 反應,也許提高 KI 的濃度,可增加 KIO3 與 KI 反應之趨勢。至於 KI 所加的量是否對反應有影響,我們可設計實驗進一步證實,若沒有影響,也許可改進此一實驗步驟,減少藥品的使用。
維生素 C 結構之五員環上面的烯二醇結構似乎沒有反覆異化的狀況,是因為兩個都是拉電子基才得以穩定嗎?如果說其中一個 OH 基被其他基團取代還有可能得以穩定烯醇結構嗎?
參考附圖,維生素C (pKa = 4.70 at 10℃)具有四種互變異構物(tautomers),中間這種維生素 C 結構最為穩定。原因是共軛的雙鍵屬於常見的 α,β-不飽和酯(α,β-unsaturated ester)因為共軛而穩定,因此它應是能量最低的結構,也是平衡中存在量最多的物種(請參考普化自由能與平衡的關係)。
除此之外,最左邊的互變異構物 結構更是非常不穩定,因兩個並排同向的 CO 雙鍵會因偶極方向相同而排斥,此外兩個具有較多部分正電荷(partial positive charge)的碳緊臨相連造成斥力。中間的羰基右測另有一拉電子的 OH,更使得其碳上的正電荷極不穩定,使得最左的結構是很不穩定的。最右方的結構亦有類似的問題,但單鍵中電子的極化不若羰基的 pi 電子那麼容易,或許沒最左的結構那麼糟。另一個互變異構物是以共軛的酮存在,但酯的結構較穩定而為主要結構。最後的結論是,這種 keto-enol 的互變異構是極快的,並非沒有反覆異化的狀況,只是以那ㄧ個最穩定的酯結構為存在的主要形式。
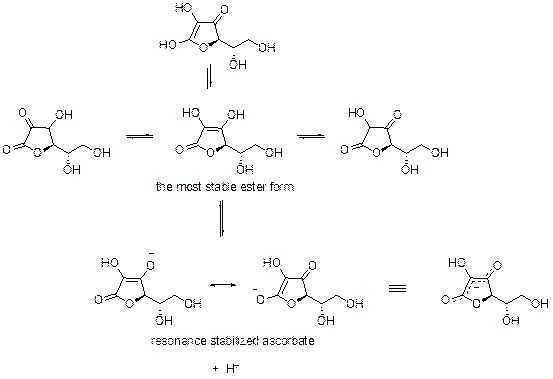
同學若還有興趣深入了解可以上網搜尋一個叫做寧海準(ninhydrin)的分子並瀏覽對其結構的討論,三個並排同向的 CO 雙鍵(在我們氧化後的維生素 C-dehydroascorbic acid 也會發生這情況)在實際上會因排斥力而形成縮醛(acetal)以穩定結構。
(103 學年黃哲凡助教)
