在實驗一中所用的 H2NSO3H,其中的硫原子好像價鍵電子超過了八個,豈不是違反了八隅體的規則?
硫原子具有與 s 及 p 軌域能階相近的 d 軌域,因此氧原子可提供其未共用電子對與硫原子空的 d軌域行 p 形式的鍵結,也由於 d 軌域的參與,使得硫原子的價鍵電子超過了八個,這種情形對週期表中較下方的元素而言是常見的。前述的看法是將兩個硫氧鍵視為雙鍵,其實也可以將這兩個鍵視為一個配位的單鍵,氧上帶負電荷而硫上帶正電荷,此時硫原子就滿足了八隅體的規則了。這兩種結構是共振的關係,在普化課程中談過了鍵結的理論之後對上述會更瞭解。
請問有效數字和常數的運算,若分析天平秤得胺基磺酸的重量 1.0258 g,而胺基磺酸分子量若是取 97,那有效數字是不是會受分子量影響,分子量算是常數嗎,因為如果分子量是常數的話?應該不會影響計算值的有效位數。
原子量只有 C-12 原子的原子量 IUPAC 規定為 12 amu,是確切的數(exact number),有效數字無限,其他元素原子量均為相對質量,不是常數,但可以依照你的計算需求,查得更精密的原子量。
例如依週期表元素原子量,得知:
- H: 1.00794 amu
- O: 15.9994 amu
- S: 32.006 amu
- N: 14.0067 amu
H2NSO3H: 1.00794×3 + 14.0067×1 + 32.006×1+ 15.9994×3 = 97.03472 = 97.035,
因此胺基磺酸的莫耳質量(molar mass)為 97.035 g/mol,
有效數字可增加,而不要用 97 (1×3 + 14×1 + 32+ 16×3 = 97)
課本附錄的飽和水蒸氣壓有效位數只有 3 位,是否會影響最後的氮氣莫耳體積有效位數?
若今天室壓為 76.57 cmHg,28℃ 時水的飽和蒸汽壓為 28.3 torr
當計算(Patm – PH2O)時,需先將二者單位轉換一致
76.57 cmHg = 765.7 mmHg
28.3 torr = 28.3 mmHg
Patm – PH2O =765.7 – 28.3 = 737.4 mmHg
仍為 4 位有效數字
關於本實驗結果之有效數字應為幾位?
本實驗結果之有效數字應表示為幾位,需視你的測量工具而定,例如:
- 使用分析天平秤得限量試劑胺基磺酸之重量為 1.0725 g(共五位有效數字)
- 胺基磺酸分子量 97.0347 g/mol,莫耳數 n = 0.011053 mol (五位有效數字)
- Patm – PH2O =765.7 – 28.3 = 737.4 mmHg (四位有效數字)
- 1 atm = 760 mmHg (有效數字無限)
- 溫度計測得 28.0℃,換算絕對溫度 T = 28.0+273.15=301.2 K (四位有效數字)
- 以秤重法,測得燒杯中排開水重量 263.47 g = 263.47 mL 水(五位有效數字)
代入算式:

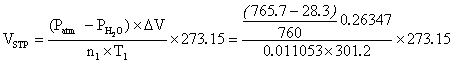
VSTP = 20.98 L (四位有效數字)
想想看:
若學生使用秤重誤差為 ±0.01 g 之電子天平秤量胺基磺酸,重量為 1.07 g,使用量筒測量排開水體積為 263 mL,則所測得之實驗結果 VSTP 應為幾位有效數字?
