關於第二個問題:考慮在恆溫的條件下壓縮一氣液。在高溫時壓力與體積的等溫曲線(P-V curve)類似於理想氣體,並無相變出現。在低於臨界溫度的情形,壓力體積變化曲線明顯地偏離理想氣體,並呈現所謂的相變化。如圖所示
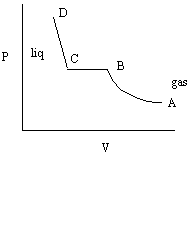
其中的AB段是氣態,CD段是液態,BC段是氣液共存,相變化是在BC段間進行。液體在等溫下膨脹,每個分子平均動能等於 3kT/2,因此在整個PV曲線不同的狀態上,僅有平均位能是不同的。從C點液體開始相變,此時壓力為常數,僅體積逐漸變大,分子間的平均距離也隨之逐漸變大,克服分子間的位能所需之能量來自外加之熱量。直到B點相變完成,分子間的平均距離比C點大得多,這是這位同學所謂的"忽然"跳遠,但是仔細看BC段的相變,微觀的分子實際上是逐漸變遠的。