蔡蘊明
於2010年十月十一日
歡迎轉載,但請註明出處
今年的諾貝爾化學獎表彰的是一種有機合成技術的發現,由於這牽涉到較高層次的化學知識,不是那麼普眾化的,即使修過大學的基礎有機化學也不見得能理解其影響,因此會有一些人問道,這真是那麼重要的技術而值得拿諾貝爾獎嗎?答案是,真的極為重要,而且這個獎給得其實晚了點。但這樣的問題促使了我在翻譯完今年諾貝爾獎委員會公佈給大眾的新聞稿之外,決定再做一點對此課題的介紹。
化學家有一種能力是別的領域如物理、材料或生物學家等等不易擁有的,那就是合成化學分子的能力。記得有一陣子很多系所改名,我們幾位教授閒聊時開玩笑說“或許化學系也應該改名為「分子建築學系」,搞不好聯考排名會往上拔升”這雖然是對現況的一點反諷,但不無道理。物理學家著重在物性,以今年的物理獎為例,得獎者取得石墨烯的方式是一種物理的剝離方式。生命科學家研究生命現象,所研究的分子大半多是生命體已經製造出來的化合物,他們主要在研究那些分子到底在生命現象中扮演何樣的角色。化學家在這些領域裡具有一種優勢,那就是他們可以針對原理及需求,設計一些化合物並在試管中製造出來,以改進原有的性能。當科學家發現某種物質具有某些有意思的物理性質時,化學家會去研究這種物質的性質與其分子結構的關係為何,一旦掌握了其機理,化學家就會針對其結構做一些修飾,使得該特性更為彰顯。對於疾病亦是如此,當生命科學家瞭解了一個疾病在分子層次的病因時,是藥學家或化學家去合成一些分子來醫治。一個成功的藥被開發出來時,它能救的生命可以是百萬或是千萬以上,絕不是一個單純的醫生能做到的。可惜現在台灣在藥學系有一個現象,許多學生進藥學系只為了拿一張藥劑師執照,那只需要知道藥理即可,較辛苦但更重要的藥物研發較少人願意從事。許多從生命體內得到的物質,常只能取得微量,要進一步研究其性質則有賴化學家來合成。
從上述我的說明,希望現在大家了解了合成化學分子的能力是很重要而獨特的。在眾多的化學分子中,有一類的化合物被稱為『有機化合物』,此名源自於早期這類化合物皆來自於天然的有機生物體,當時的科學家甚至於認為這類化合物是神聖的,除了大自然外不可能以人工的方式製造出來。當然這樣的迷思早被化學家打破,但這類的化合物在生命的體系中常扮演極為重要的角色。它們在結構上有一種特質,那就是一律具有碳原子與碳原子連結而成的結構骨幹,也因此當化學家要合成有機化合物時,碳─碳鍵結的建立是非常重要的,這正是成為化學的一個重要領域:「有機合成」的重要目標。
化學分子的結構千奇百怪,製造一個分子的方式普遍是由下而上,也就是透過一些小分子相互的連結而逐漸構築出完整的架構,化學家在建立碳─碳鍵結時不能只擁有一種方法,因為如果只有一種方法的話,化學家很快就會技窮。那就好像一個工匠,要擁有應付各種需求的工具,才能更有效率的完成其作品。也因此化學家發展了各種各樣的合成方法,來應付可能碰到的各種難題。
基本上好的方法要能夠在很溫和的條件執行,產率要很高效率才會好。簡單的計算會告訴你,每一個步驟如果只能達到百分之八十的產率,那麼五個步驟之後總產率就掉到百分之三十。從基本的概念來看碳─碳鍵結的生成,通常化學家會去操弄鍵結的極性,要將兩個碳原子連結起來時,會希望一個碳原子上具有正電的性質,而另一個碳原子上具有負電的性質,二者就容易結合。例如1912年的諾貝爾化學獎給的格林納反應 (Grignard reaction),是一個建立碳─碳鍵結很重要的方法 (圖一),這個反應需要先製造出一個化合物,其中碳原子與鎂原子連結,由於鎂原子的電負度比碳原子低很多,所以這個碳原子因為電子的偏移,其上會具有相當高的負電荷;這個反應需要的另一個角色是一個具有碳氧雙鍵的化合物,氧原子的電負度比碳原子高很多,電子偏移向氧一方,導致碳原子上會具有相當高的正電荷性質,因此在這個極性的原則下,格林納反應成為一個非常成功的反應,能將兩個碳連結。在大學修習基礎有機化學時,學生都會學到這個重要的化學反應。
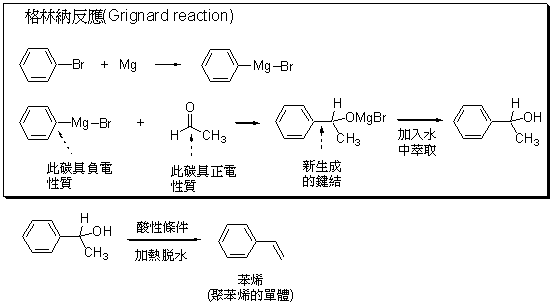
在七零年代之前,大部分建立碳─碳鍵結的方法,以兩個碳原子在結構上所使用的軌域做區分的話,都是牽涉到建立sp3-sp3、sp2-sp3 或 sp-sp3 形式的鍵結,對於建立sp2-sp2 或 sp-sp2 型態的鍵結是非常困難而且沒有效率的。今年的諾貝爾化學獎得主理察海克從1968年開始發表了一系列的研究 (圖二),提供了一種有效率的方法來建立sp2-sp2 型態的鍵結。實際上當年有另一位日本教授 Tsutomu Mizoroki 比海克早了一點點發現類似的反應,只不過Mizoroki教授沒多久因病過逝,未能在這個領域多做貢獻。初期的海克反應具有較多的限制,但是由於化學家對這種獨特的反應的重視,越來越多的人投入研究改進,因此到了八零年代就已經開發出許多更為有用的方法。
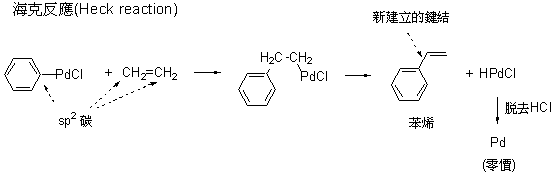
海克反應成功的關鍵在運用了鈀金屬來催化這樣的反應,鈀金屬是屬於過渡族的元素,這一族類的化合物與有機鹵化物(具有碳與鹵素的鍵結)會有一些非傳統的化學反應發生,成就了另外一個重要的領域稱為「有機金屬化學」,它們常可以催化的方式執行許多早期無法做到或沒有效率的反應,這其中鈀金屬是個中翹楚,它的化學可寫出厚厚的好幾本書。回到海克反應中鈀金屬的角色,首先它有一個獨特的反應就是可以插入在sp2 碳與鹵素原子的鍵結之間,鹵素原子在鈀原子上成為一個可以被取代的配位體,碳─碳雙鍵正可以取代鹵素原子成為鈀原子上的新配位體,此時兩個被拉近的碳就因 為鈀原子的媒介而連結生成新的碳─碳鍵結,鈀原子則脫離恢復原狀,準備進行下一輪的反應。
早期的海克反應有一些缺點,因為碳─碳雙鍵是由兩個碳組成,當雙鍵是不對稱時(各接有不同的取代基),新的鍵結生成時到底要與哪一個碳反應呢?也就是有位置選擇上的問題,如何精確的控制是努力的方向。鈴木反應在這方面提供了一個很好的解決方案,這個反應中使用了硼這個元素 (圖三),將它接在碳─碳雙鍵的其中一個碳上,硼原子會將接於其上的碳─碳雙鍵轉移到鈀原子上,如此就解決了位置選擇性的問題。硼的化合物製備不難,毒性不高,適合大量合成,因此變成一個非常熱門的方法。根岸反應則是使用鋅這個元素,扮演與硼類似的角色,但另有其妙處,因涉較高階的化學,此處不多做說明。
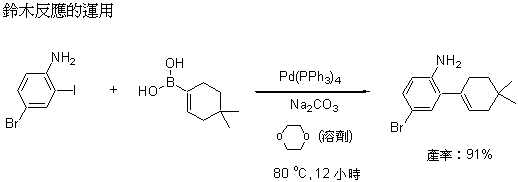
隨著這類反應進一步的發展,到了八零年代末期,傳統的有機合成化學家開始逐漸注意到這類反應帶來的新機會,許多過去不易合成的複雜分子常可運用這種新技術來製備,並且在九零年代蔚為風潮。
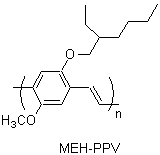
進入了二十一世紀,材料科學逐漸成為焦點,科學家開始追求具有特殊光電性質的材料,有機的小分子以及聚合物受到很大的重視,這是因為有別於無機化合物(通常不含碳元素)的材料,有機的化合物有機會用簡單的塗佈或印刷的方式安置在軟性的基材上,不但易於製造還可以隨意曲折。這些具有特殊光電性質的有機材料在結構上有一個特點 (圖四),那就是具有許多相連接的碳─碳雙鍵,這個結構上的特點不就是上述海克反應等所專精之處嗎!因此拜其所賜,具有各種結構的化合物被合成出來接受測試,其性能正不斷的提升,相信在不久的將來,上述提到的夢幻電子產品將會問世。
總括而言,今年的三位諾貝爾化學獎得主所發展的合成工具,為有機合成開創了新的機會,導致了革命性的進展,許多過去不易合成的化合物,常可用他們的方法來合成,因此他們的獲獎絕對是實至而名歸的。
今年諾貝爾化學獎的公佈,讓某些人認為終於給了真正做化學的人!的確,近年來有好多屆的諾貝爾化學獎給了一些研究生命科學的人,從表面上看,好像化學勢微了,然而仔細去看那些得獎的人,他們乃是運用化學的方法來探究生命科學的問題,當然可以稱他們為化學家,如果只從表象去看諾貝爾化學獎的意義,那就太過於膚淺了。例如最近有人問我有關2003年的諾貝爾化學獎的離子通道問題,他不能理解為什麼水分子就不能通過,這樣的疑惑就是沒有化學作為基礎而產生的。近年來奈米科學受到注重,許多其它學門的人或許會覺得那裡面的化學很容易做,照著處方很輕易的就可以做出來,所以化學也沒什麼困難,然而如果忽略了化學就沒有辦法去理解裡面牽涉的化學原理,也就沒有辦法去設計新的材料,說實在的,現在研究材料科學不多學些化學,那就只能在一些物理性質上打轉了。從諾貝爾化學獎近年給獎的趨勢來看,跨領域的研究之重要才是其精神之所在。反過來看,研究化學的人如果忽略了其它的領域,那麼他們也會喪失領先的機會。
當然化學裏面還是有許多的研究領域,是外人從表象看不出其所以然的東西,今年諾貝爾化學獎得主所做的研究,必須對有機合成這個領域有所瞭解,才能知其偉大,這也是我為文解說的目的。
參考資料
- Bäckvall, J.-E. 諾貝爾化學獎委員會公佈的科學背景資料:http://static.nobelprize.org/nobel_prizes/chemistry/laureates/2010/Sciback_2010.pdf
- 圖三例:Illig, C. R.; Ballentine, S. K.; Chen, J.; DesJarlais, R. L.; Meegalla, S. K.; Wall, M.; Wilson, K. 專利 US2007/249649 A1, 2007.