林宇軒,曹一允,蔡蘊明合譯
於2017年十月五日
歡迎轉載,但請引述本網址
本文譯自諾貝爾化學獎委員會公佈給大眾的新聞稿,原文可自以下官方網站取得:
https://www.nobelprize.org/nobel_prizes/chemistry/laureates/2017/popular-chemistryprize2017.pdf
若有興趣閱讀進階的資料,請由下列網址取得:
https://www.nobelprize.org/nobel_prizes/chemistry/laureates/2017/advanced-chemistryprize2017.pdf
*譯者簡介:
林宇軒於台大化學系碩士班畢業,受教於李弘文教授,於瑞典Umeå大學做過一年交換學生。
曹一允在美國德州農工大學攻讀博士,在Karen Wooley教授實驗室進行研究,除翻譯本文外亦負責將其中圖片中文化。
蔡蘊明現為台大化學系名譽教授。
*感謝台大化學系的蔡明軒幫忙將此文放上化學系的網頁。
將生命捕捉在原子的細節中
Jacques Dubochet(杜波克特)、Joachim Frank (法蘭克)、與Richard Henderson (韓德森)獲得了今年諾貝爾化學桂冠,表彰他們為取得生命分子的三維影像所發展的一種有效方法。運用低溫電子顯微術,研究人員現在能將生物分子在行動中凍結並以原子的尺度描繪之,這種技術將生物化學帶入了一個新的紀元。
過去這幾年,各種生物分子機器令人驚訝的結構充斥在各種科學文獻中(圖一):沙門氏桿菌(salmonella)攻擊細胞所用的注射針;具有抵抗化學治療及抗生素的蛋白質;控制晝夜節律的蛋白質錯合物;光合作用中捕捉光線的反應錯合物以及一個能讓我們聽見的壓力感測器,這些只是現在用低溫電子顯微術(簡稱cryo-EM)顯像的數百個生物分子中的幾個例子。
當研究人員開始懷疑茲卡(Zika)病毒是造成巴西新生兒腦部損傷的流行病元凶時,他們利用cryo-EM來觀察這個病毒,在幾個月內就得到具有原子解析度的病毒三維影像,使得研究者能開始尋找其結構中潛在的藥物標靶。
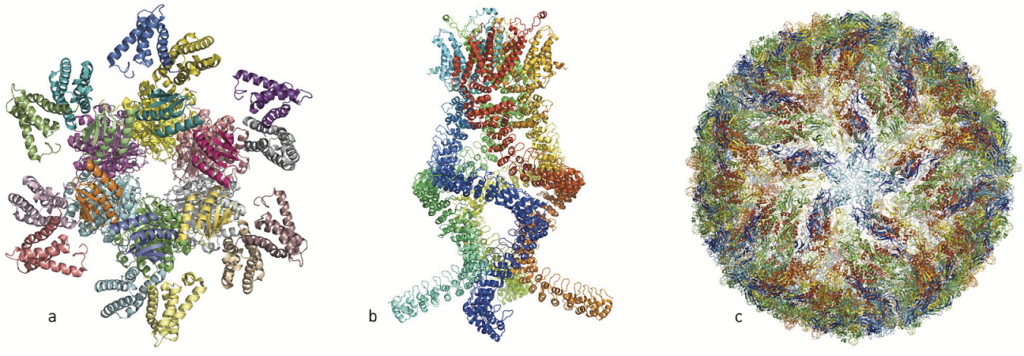
杜波克特、法蘭克、與韓德森等人突破性的發現,成就了cryo-EM的發展,這個方法帶領生物化學進入了一個新的紀元,讓它比以前更容易捕捉生物分子的影像。
影像-獲取知識的重要關鍵
在20世紀前半頁,生物分子 – 蛋白質、DNA以及RNA – 仍是生物化學的地圖中一塊未知的新大陸。科學家知道這些分子在細胞內扮演著十分重要的角色,但卻對它們的外觀毫無概念。直到1950年代,劍橋大學的科學家們把蛋白質結晶放到X射線底下,才能夠第一次看出其波浪和螺旋形的結構。
1980年代早期,X射線晶體學與核磁共振譜法(NMR spectroscopy)分別用來研究固體和溶液中的蛋白質。這種技術不只揭示了蛋白質的結構,也暴露了它們如何移動以及與其它分子相互作用。
多虧了這兩種方法,現在我們有包含數千種生物分子模型的資料庫,能夠用於從基礎研究到藥物發展的各個領域。然而,這兩種方法都有其根本上的限制。溶液的核磁共振譜法只適用於比較小的蛋白質,X射線晶體學則需要分子形成結構整齊的晶體,像是水結成冰一樣,而這些晶體影像就像早期相機取得的黑白肖像 – 它們僵硬的姿態幾乎無法顯示出蛋白質的動力學。
此外,很多分子無法自行排列形成晶體,這讓韓德森在1970年代放棄了使用X射線晶體學 – 這也正是2017年諾貝爾化學獎故事的開端。
晶體的諸多問題使韓德森轉換跑道
韓德森的博士學位是在X射線晶體學的堡壘 – 英國劍橋獲得的。他運用X射線晶體學使蛋白質成像,但在試圖結晶一種天然嵌入細胞膜中的蛋白質時碰了釘子。
膜蛋白是相當難以處理的,當它們從原本環境的細胞膜中移除時,經常會堆積成一團無用的物質。韓德森研究的第一個膜蛋白相當難以製備足夠的量,第二個膜蛋白則是無法結晶。經過多年的挫敗,他決定轉向唯一可行的替代方案:電子顯微鏡。
當然電子顯微術是否真是一個替代方案這點,在當時仍是可議的。穿透電子顯微術,正如其名,運作類似普通的顯微鏡,不過卻是用電子束而非光來穿透樣品。因為電子的波長比可見光小得多,電子顯微鏡能夠看到非常小的結構 – 甚至是個別原子的位置。
因此,理論上電子顯微鏡的解析度應該遠高於韓德森用來研究膜蛋白的原子結構所需的解析度,但實際上這個計畫幾乎不可行。1930年代電子顯微鏡發明時,科學家認為這種技術只適用於非活體,因為高解析度影像所需的高強度電子束,會燒毀生物材料。但若減弱電子束的強度,影像則會失去對比度而變得模糊。
除此之外,電子顯微術需要真空環境,這條件之下生物分子會因周遭水分蒸發而變質。生物分子乾燥之後會折疊並失去原本的結構,使得到的影像失去意義。
幾乎種種跡象都表明韓德森會失敗,但這個研究計畫被他選擇的特殊蛋白質“菌紫質”拯救了。
韓德森而言迄今最好的還不夠好
菌紫質是一種光合生物體中嵌入細胞膜的紫色蛋白質,用以攫取來自太陽光的能量。並非像先前一樣把敏感的蛋白質從細胞膜分離,韓德森和他的同事直接把整個紫色的細胞膜放到電子顯微鏡底下,這樣被細胞膜包圍的蛋白質會保持原本的結構。他們在樣品表面加上葡萄糖溶液,用來保護蛋白質不在真空底下乾掉。
強烈的電子束是一個主要的問題,而其研究人員利用菌紫質分子堆疊在細胞膜中的特性解決了。他們並未使用全劑量的電子轟擊,改以較弱的電子束流過樣品。雖然這樣拿到的圖像並沒有很好的對比度,也沒辦法看清個別分子,但這種蛋白質整齊堆疊成相同方向的特性,讓研究人員知道所有蛋白質繞射電子的模式應該幾乎相同,由此他們能夠從繞射圖中計算出更詳細的影像 – 類似X射線晶體學中使用的數學方法。
下一個階段中,研究人員轉動電子顯微鏡底下的細胞膜,得到許多不同角度的影像。利用這個方法,在1975年建構了菌紫質結構的粗略3D模型(圖2),顯示蛋白質鏈是如何在細胞膜內穿越七次。
這是當年有史以來用電子顯微鏡得到的蛋白質影像中品質最好的,那7埃(0.0000007毫米)的解析度在很多人心目中留下了深刻的印象。不過這對韓德森而言還是不夠,他的目標是能夠達到X射線晶體學所能提供的解析度,也就是大約3埃,而他堅信電子顯微術還可做得更好。

韓德森得到第一個原子解析度的影像
在接下來的幾年,電子顯微術的技術逐漸進步。鏡片變得更好,加上冷凍技術的進展(我們後續會談到),在測量過程中用液態氮冷卻樣品,防止它們被電子束損壞。
韓德森逐漸在菌紫質的模型中添加更多細節。為了獲得最清晰的影像,他尋找著世界上最好的電子顯微鏡。每個電子顯微鏡都有個自的缺點,不過彼此之間有辦法相互補足。終於,在1990年,也就是發表第一個模型的15年後,韓德森達到了他的目標,並發表了一個解析度到達原子尺度的菌紫質結構(圖3)。

他因此證明了cryo-EM可以提供與使用X射線晶體學相同細節的影像,這是個關鍵的里程碑。然而,這個進展是建立在一個特殊的情況:蛋白質能夠自然地在膜中整齊堆疊。很少有其它蛋白質以這種方式自發地排列。問題是這種方法可否推廣:能否使用電子顯微鏡從隨機分散在樣品中並以不同方向排列的蛋白質產生高解析度3D影像?韓德森相信有辦法做到,然而其他人卻覺得這只是個烏托邦的理想而已。
在大西洋的另一側,美國紐約州衛生署的法蘭克長期以來也一直在尋找解決這個問題的方案。1975年,他提出了一個理論上的策略,顯微鏡二維圖像中顯然只能得到的少數資訊,可以合併得到三維高解析度的影像。他花了超過十年的時間實現了這個想法。
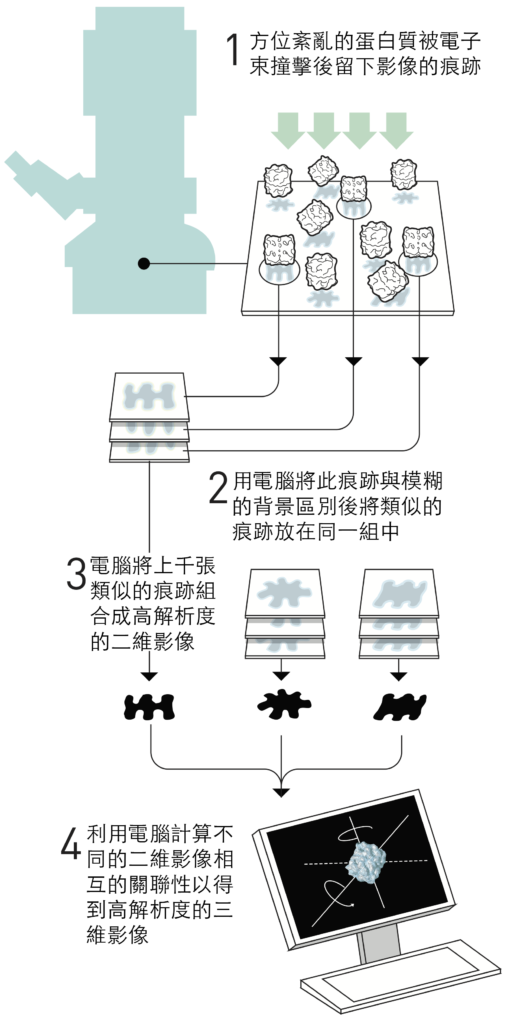
法蘭克去蕪存菁的影像分析法
法蘭克的策略(圖4)是將電子顯微鏡所得方位紊亂之蛋白質的微弱影像,利用電腦將之與背景區別開來。他開發了一種數學方法,使電腦能夠辨識出影像中不同的重複圖形。接著,電腦將相似的圖形分類到同一組,並將這些圖形中的訊息合併,產生出平均的、更清晰的影像。藉由這個方法,他得到了一些同種蛋白質但從不同角度照出來的高解析度二維影像。該軟體的演算法於1981年完成。
下一步,是在數學上確定不同的二維影像如何彼此相關,並且基於這些訊息建立出三維影像。法蘭克在1980年代中期出版了這個部分的影像分析方法,並用它產生出核醣體表面的模型,那是細胞內製造蛋白質的巨大分子機械。
法蘭克的影像處理方法是cryo-EM的重要發展。現在讓我們跳回到幾年前 – 在1978年,當法蘭克將電腦程式優化得更完美的同時,杜波克特被招募到了海德堡的歐洲分子生物學實驗室,以解決另一個電子顯微鏡的基本問題:生物樣品暴露於真空時,是如何乾燥與損壞的。
杜波克特將水變成玻璃
1975年,韓德森使用葡萄糖溶液來保護細胞膜以避免脫水,但是這種方法對水溶性生物分子無效。其他研究人員試圖冷凍樣品,因為冰比水蒸發得慢,不過冰晶會使電子束受到嚴重干擾,使得影像無法分析。
水的汽化是一個主要的難題,然而,杜波克特想到了一個可能的方法:快速將水冷卻,使水分子以液體的形態固化,形成玻璃而不是晶體。玻璃看起來是固體材料,但實際上卻是一種流體,因為它的分子呈現無序的排列。杜波克特意識到,如果他能夠將水形成玻璃 – 也稱為玻化水(vitrified water) – 電子束將平均地繞射,並產生均勻的背景影像。
一開始,研究團隊試圖在液氮中 -196 °C 下將微小水滴玻璃化,但只有當他們改用被液態氮冷卻的乙烷時,實驗才會成功。在顯微鏡下,他們看見了一個過去不曾見過的滴狀物,他們起初認為是乙烷,但是當溫度稍微升高時,分子突然重新排列,形成了一個熟悉的冰晶結構。這可說是一大勝利 – 特別是有些研究人員曾斷言不可能使水滴玻璃化。我們現在相信,玻化水是宇宙中最常見的水之結構。
一種求取對比的簡單技術
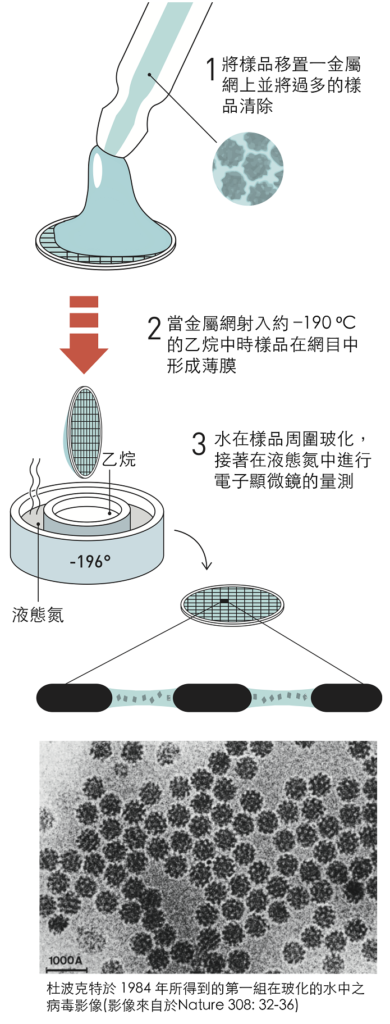
1982年的突破之後,杜波克特的研究小組迅速開發出了目前仍用於低溫電子顯微鏡的技術基礎(圖5)。他們將生物樣品 – 最初是不同形式的病毒 – 溶解在水中,然後將溶液以薄膜的形式鋪展在細金屬網目上。他們使用一種似弓的裝置將金屬網目射入液態乙烷中,使薄膜中的水玻璃化。
1984年,杜波克特發表了許多不同病毒的第一張影像,圓形和六邊形的高對比病毒影像襯托在玻化水的背景中。用於電子顯微鏡的生物材料樣品現在可以更容易地製備了,研究人員們趕快敲著杜波克特的大門來學習新技術。
從團塊學到革命性的進展
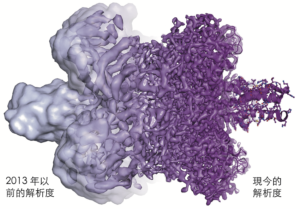
至此,cryo-EM最重要的一塊拼圖已經到位,但影像解析度仍然很差。1991年,當法蘭克用杜波克特的玻璃化方法製備核醣體並用自己的軟體分析圖像時,他獲得了一個空間解析度為 40埃的三維結構。這對電子顯微術來說,是一個驚人的進步,但影像只能顯示核醣體的輪廓。坦白說,它看起來像一群團塊,影像遠遠比不上X射線晶體學的原子級解析度。
由於cryp-EM除了看到不平坦的表面之外,很少能將結構細節顯像出來,所以該方法有時被戲稱為「團塊學(blobology)」。然而,電子顯微鏡的每個螺帽和螺絲逐漸被優化,這最主要是由於韓德森固執地保持其遠見:電子顯微鏡將有一天能例行地提供顯示到單個原子層次的影像。解析度一個埃一個埃往前拓展,最終在2013年使用了一種新型的電子探測器,克服了最後的技術障礙(圖6)。這些進步有賴下列的一些發展:訊號偵測器的進步,導致訊號/雜訊比例以及空間解析度的大幅提升;電子槍的改進;新式相位板有助於相位處理;數據收集的自動化;影像處理技術的改進以及電腦程式的開發。
細胞中任何隱藏的角落皆可探索
現在夢想已經實現,我們正面對著生物化學中爆炸性的發展。使得cryo-EM之所以如此的具有革命性是因為它的許多優點:杜波克特的玻化方法容易使用並且只需微量的樣品,由於其快速冷卻的方式,生物分子能在行動中被凍結,使得研究者能捕捉到反應過程中一系列的影像,如此他們能取得暴露出蛋白質如何行動並與其它分子作用的“影片”。
運用cryo-EM也使得我們遠較以往更容易描繪膜蛋白,它們常扮演藥物的標靶角色以及形成巨大的分子錯合物。不過小分子無法用電子顯微術來研究,但它們可運用核磁共振譜法或X-射線晶體學來顯像。
在法蘭克於1975年提出其廣泛影像處理方法的對策之後,一位研究者寫道:「如果這個方法能完美化,那麼就如同一位科學家所說的,只有天空才會是我們的極限(任何事情都是可能的)」。
現在我們已經到了那兒 – 天空的極限。透過杜波克特、法蘭克、與韓德森等人的研究,帶來了“人類最大的利益”。每一個細胞的角落均可捕捉到原子層次的細節,而生物化學已經準備好迎接一個精彩的未來。